[SBT Hóa Lớp 10 Kết nối tri thức] Bài 12. Liên kết cộng hóa trị trang 32, 33 SBT Hóa 10 Kết nối tri thức với cuộc sống
Hướng dẫn học bài: Bài 12. Liên kết cộng hóa trị trang 32, 33 SBT Hóa 10 Kết nối tri thức với cuộc sống - Môn Hóa học Lớp 10 Lớp 10. Đây là sách giáo khoa nằm trong bộ sách 'SBT Hóa Lớp 10 Kết nối tri thức Lớp 10' được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết các bé sẽ nắm bài học tốt hơn.
nhận biết 12.1
liên kết cộng hóa trị là liên kết hoá học được hình thành giữa hai nguyên tử bằng
a. một electron chung.
b. sự cho - nhận electron.
c. một cặp electron góp chung.
d. một hay nhiều cặp electron dùng chung.
phương pháp giải:
dựa vào định nghĩa của kiên kết cộng hóa trị: liên kết cộng hóa trị là liên kết được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung
lời giải chi tiết:
- đáp án: d
nhận biết 12.2
hợp chất nào sau đây có liên kết cộng hoá trị không phân cực?
a. licl.
b. cf2cl2.
c. chcl3.
d. n2.
phương pháp giải:
dựa vào hiệu độ âm điện:
|
hiệu độ âm điện (\(\delta \chi \)) |
loại liên kết |
|
\(0 \le \delta \chi < 0,4\) |
cộng hóa trị không phân cực |
|
\(0,4 \le \delta \chi < 1,7\) |
cộng hóa trị phân cực |
|
\(\delta \chi \ge 1,7\) |
ion |
- các phân tử chỉ gồm 2 nguyên tử của 1 nguyên tố có liên kết cộng hóa trị không phân cực. ví dụ như: h2, cl2, o2,…
lời giải chi tiết:
- đáp án: d
nhận biết 12.3
hợp chất nào sau đây có liên kết cộng hoá trị phân cực?
a. h2.
b. chcl3.
c. ch4.
d. n2.
phương pháp giải:
dựa vào hiệu độ âm điện:
|
hiệu độ âm điện (\(\delta \chi \)) |
loại liên kết |
|
\(0 \le \delta \chi < 0,4\) |
cộng hóa trị không phân cực |
|
\(0,4 \le \delta \chi < 1,7\) |
cộng hóa trị phân cực |
|
\(\delta \chi \ge 1,7\) |
ion |
lời giải chi tiết:
|
|
phân tử chcl3 |
phân tử ch4 |
|
hiệu độ âm điện (\(\delta \chi \)) |
- liên kết c-h có \(\delta \chi \) = 2,55 - 2,20 = 0,35 -> liên kết cộng hóa trị không phân cực - liên kết c-cl có \(\delta \chi \) = 3,16 - 2,55 = 0,61 -> liên kết cộng hóa trị phân cực |
- liên kết c-h có \(\delta \chi \) = 2,55 - 2,20 = 0,35 -> liên kết cộng hóa trị không phân cực |
=> đáp án: b
nhận biết 12.4
liên kết σ là liên kết hình thành do
a. sự xen phủ bên của hai orbital.
b. cặp electron dùng chung.
c lực hút tĩnh điện giữa hai ion.
d. sự xen phủ trục của hai orbital
lời giải chi tiết:
- đáp án: d
nhận biết 12.5
liên kết π là liên kết hình thành do
a. sự xen phủ bên của hai orbital.
b. cặp electron dùng chung.
c lực hút tĩnh điện giữa hai ion.
d. sự xen phủ trục của hai orbital.
lời giải chi tiết:
- đáp án: a
nhận biết 12.6
liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p?
a. h2.
b. cl2.
c. nh3.
d. hcl.
phương pháp giải:
dựa vào: phân lớp electron ngoài cùng chưa được bão hòa trong nguyên tử sẽ tham gia liên kết
lời giải chi tiết:
lời giải chi tiết:
- cấu hình electron của h: 1s1
- cấu hình electron của cl: 1s22s22p63s23p5
- cấu hình electron của n: 1s22s22p3
-> để tạo thành sự xen phủ orbital p-p thì 2 nguyên tử tham gia phải có phân lớp electron ngoài cùng chưa được bão hòa là phân lớp p
=> đáp án: b
nhận biết 12.7
liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s-s?
a. h2.
b. cl2.
c. nh3.
d. hcl.
phương pháp giải:
dựa vào: phân lớp electron ngoài cùng chưa được bão hòa trong nguyên tử sẽ tham gia liên kết
lời giải chi tiết:
- cấu hình electron của h: 1s1
- cấu hình electron của cl: 1s22s22p63s23p5
- cấu hình electron của n: 1s22s22p3
-> để tạo thành sự xen phủ orbital s-s thì 2 nguyên tử tham gia phải có phân lớp electron ngoài cùng chưa được bão hòa là phân lớp s
=> đáp án: a
vận dụng 12.8
liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s-p?
a. h2.
b. cl2.
c. nh3.
d. o2.
phương pháp giải:
dựa vào: phân lớp electron ngoài cùng chưa được bão hòa trong nguyên tử sẽ tham gia liên kết
lời giải chi tiết:
- cấu hình electron của h: 1s1
- cấu hình electron của cl: 1s22s22p63s23p5
- cấu hình electron của n: 1s22s22p3
- cấu hình electron của o: 1s22s22p4
-> để tạo thành sự xen phủ orbital s-p thì 2 nguyên tử tham gia phải có phân lớp electron ngoài cùng chưa được bão hòa là phân lớp s và phân lớp p
=> đáp án: c
thông hiểu 12.9
các liên kết trong phân tử oxygen gồm
a. 2 liên kết π.
b. 2 liên kết σ.
c. 1 liên kết σ, 1 liên kết π.
d. 1 liên kết σ.
phương pháp giải:
dựa vào
- các liên kết cộng hóa trị đơn đều là liên kết σ
- 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π
- 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π
lời giải chi tiết:
- công thức cấu tạo của phân tử oxygen: o=o
-> các liên kết trong phân tử oxygen gồm 1 liên kết σ và 1 liên kết π
=> đáp án: c
thông hiểu 12.10
số liên kết σ và π có trong phân tử c2h2 lần lượt là
a. 2 và 3.
b. 3 và 1.
c. 2 và 2.
d. 3 và 2
phương pháp giải:
dựa vào
- các liên kết cộng hóa trị đơn đều là liên kết σ
- 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π
- 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π
lời giải chi tiết:
lời giải chi tiết:
- công thức cấu tạo của phân tử c2h2: h-c≡c-h
-> các liên kết trong phân tử c2h2 gồm 3 liên kết σ và 2 liên kết π
=> đáp án: d
thông hiểu 12.11
dãy nào sau đây gồm các chất chỉ có liên kết cộng hoá trị?
a. bacl2, nacl, no2.
b. so2, co2, na2o2.
c. so3, h2s, h2o.
d. cacl2, f2o, hcl
phương pháp giải:
dựa vào:
- liên kết cộng hóa trị được hình thành giữa các nguyên tử giống hoặc gần giống nhau về bản chất hóa học
- liên kết ion được hình thành giữa các nguyên tử kim loại điển hình và các nguyên tử phi kim điển hình
lời giải chi tiết:
- đáp án: c
thông hiểu 12.12
cho hai nguyên tố x (z = 20) và y (z = 17). công thức hợp chất tạo thành từ nguyên tố x, y và liên kết trong phân tử là
a. xy: liên kết cộng hoá trị.
b. x2y3: liên kết cộng hoá trị.
c. x2y: liên kết ion.
d. xy2: liên kết ion.
phương pháp giải:
- xác định vị trí của các nguyên tố x và y trong bảng tuần hoàn
- dự đoán tính chất kim loại và phi kim của x và y
- tìm công thức hợp chất tạo thành từ x và y
lời giải chi tiết:
- cấu hình electron nguyên tử x: 1s22s22p63s23p64s2
-> x là nguyên tố calcium (ca) ở chu kì 4, nhóm iia, ô số 20
-> ca là nguyên tố kim loại mạnh
- cấu hình electron nguyên tử y: 1s22s22p63s23p5
-> y là nguyên tố chlorine (cl) ở chu kì 3, nhóm viia, ô số 17
-> cl là nguyên tố phi kim điển hình
=> đáp án: d
thông hiểu 12.13
độ âm điện của nitrogen gần bằng độ âm điện của chlorine nhưng ở điều kiện thường n2 hoạt động kém cl2. giải thích.
phương pháp giải:
dựa vào cấu tạo của phân tử n2 và cl2. phân tử nào có liên kết bền vững hơn thì kém hoạt động hơn
lời giải chi tiết:
- cấu tạo của phân tử n2: n≡n
- cấu tạo của phân tử cl2: cl-cl
-> ở điều kiện thường, phân tử nitrogen có liên kết ba bền vững nên để tham gia vào phản ứng hóa học cần cung cấp nhiều năng lượng để phá vỡ liên kết ba đó. còn phân tử chlorine chỉ có liên kết đơn nên dễ phá vỡ hơn
-> ở điều kiện thường, phân tử nitrogen hoạt động kém hơn phân tử chlorine
vận dụng 12.14
cho các phân tử sau f2, n2, h2o, co2.
a) hãy viết công thức lewis của các phân tử đó.
b) hãy cho biết phân tử nào chứa liên kết cộng hóa trị phân cực và phân tử nào chứa liên kết cộng hoá trị không phân cực, phân tử nào phân cực và phân tử nào không phân cực.
phương pháp giải:
- bước 1: viết cấu hình electron của các nguyên tử
- bước 2: xác định số electron lớp ngoài cùng
- bước 3: viết công thức electron của phân tử => công thức lewis
lời giải chi tiết:
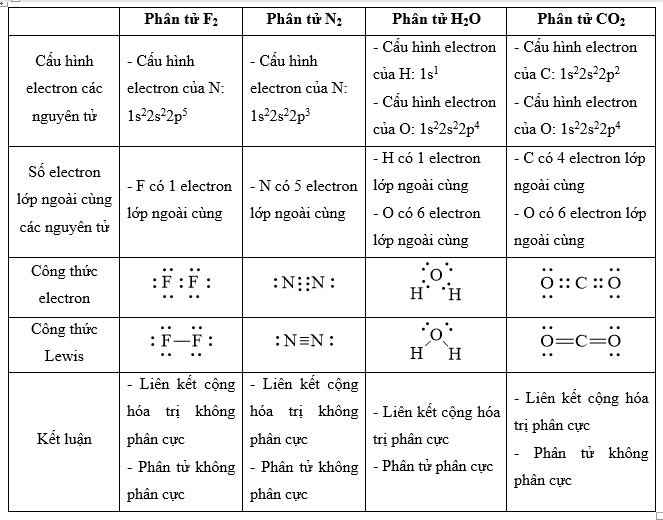
vận dụng 12.15
cho các phân tử sau: br2, h2s, ch4, nh3, c2h4, c2h2.
a) phân tử nào có liên kết cộng hoá trị không phân cực? phân tử nào có liên kết cộng hóa trị phân cực?
b) phân tử nào chỉ có liên kết đơn? phân tử nào có liên kết đôi? phân tử nào có liên kết ba?
phương pháp giải:
- bước 1: viết cấu hình electron của các nguyên tử
- bước 2: xác định số electron lớp ngoài cùng
- bước 3: viết công thức electron của phân tử => công thức lewis
lời giải chi tiết:
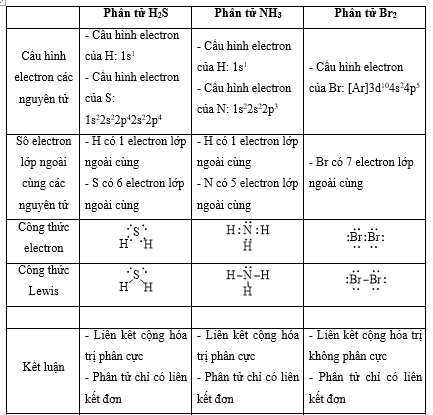
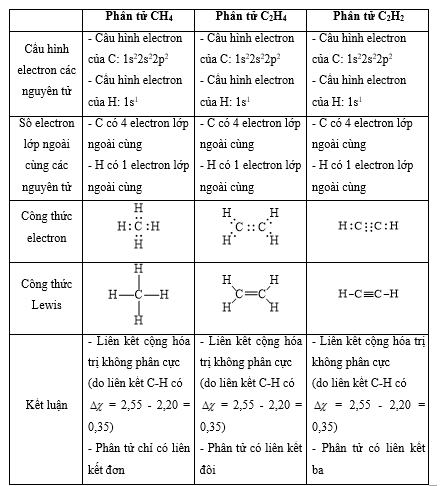
vận dụng 12.16
ghép nhiệt độ nóng chảy với chất tương ứng và giải thích.
|
chất |
nhiệt độ nóng chảy (°c) |
|
a) nước |
1) -138 |
|
b) muối ăn |
2) 80 |
|
c) băng phiến |
3) 0 |
|
d) butane |
4) 801 |
phương pháp giải:
dựa vào đặc điểm của các liên kết
- hợp chất chứa liên kết cộng hóa trị có nhiệt độ sôi và nhiệt độ nóng chảy thấp
- hợp chất chứa liên kết ion có nhiệt độ sôi và nhiệt độ nóng chảy cao
lời giải chi tiết:
- muối ăn là hợp chất ion -> nhiệt độ nóng chảy cao nhất -> b - 4
- nước có nhiệt độ nóng chảy là 0 -> a - 3
- butane là chất khí nên nhiệt độ nóng chảy thấp nhất -> d - 1
- còn lại là băng phiến -> c - 2