[Lý thuyết Hóa Lớp 11] Khái niệm tích số ion của nước và thang pH
Hướng dẫn học bài: Khái niệm tích số ion của nước và thang pH - Môn Hóa học Lớp 11 Lớp 11. Đây là sách giáo khoa nằm trong bộ sách 'Lý thuyết Hóa Lớp 11 Lớp 11' được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết các bé sẽ nắm bài học tốt hơn.
tích số ion của nước là gì?
\({h_2}o \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {h^ + } + o{h^ - }\)
\({k_{\rm{w}}} = {\rm{[}}{{\rm{h}}^{\rm{ + }}}{\rm{][}}o{h^ - }{\rm{]}}\)
ở 250c, \({k_{\rm{w}}} = {\rm{[}}{{\rm{h}}^{\rm{ + }}}{\rm{][}}o{h^ - }{\rm{]}}\)=10-14 (không đổi)
ph là gì? cách tính ph của dung dịch?
ph là đại lượng đặc trưng cho mức độ acid base của một dung dịch
công thức tính: \(ph = - \lg [{h^ + }{\rm{]}}\)
thang ph là gì?
ph có giá trị từ 1 đến 14
với ph < 7 --> môi trường acid
ph > 7 --> môi trường base
ph = 7 --> môi trường trung tính
chất chỉ thị ph là gì? có mấy loại chất chỉ thị ph?
chất chỉ thị ph để cho biết dung dịch có tính acid hay base.
có nhiều loại chất chỉ thị, thường dùng như: giấy quỳ tím, phenolphthalein, methyl da cam.
phương pháp chuẩn độ dung dịch acid và base là gì?
là phương pháp xác định nồng độ của một chất trong dung dịch bằng một dung dịch khác đã biết nồng độ.
muốn xác định nồng độ của dung dịch naoh bằng dung dịch hcl đã biết nồng độ. người ta tiến hành phương pháp chuẩn độ.
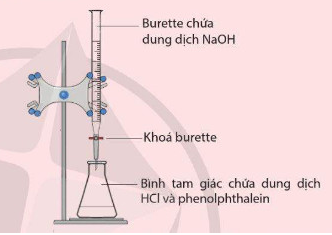
sau khi chuẩn độ xong, ta có công thức: \({c_{{m_{naoh}}}}.{v_{naoh}} = {c_{{m_{hcl}}}}.{v_{hcl}}\)