[SGK Khoa học tự nhiên Lớp 8 Cánh diều] Chủ đề 1. Phản ứng hóa học
Hướng dẫn học bài: Chủ đề 1. Phản ứng hóa học - Môn Khoa học tự nhiên Lớp 8 Lớp 8. Đây là sách giáo khoa nằm trong bộ sách 'SGK Khoa học tự nhiên Lớp 8 Cánh diều Lớp 8' được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết các bé sẽ nắm bài học tốt hơn.
CH tr 12 MĐ
Quan sát hình 1.1, dự đoán hình nào mô tả hiện tượng chất bị biến đổi thành chất khác, hình nào chỉ mô tả sự thay đổi về tính chất vật lí (trạng thái, kích thước, hình dạng, ….)?
Phương pháp giải:
Dựa vào hình 1.1 và kiến thức về biến đổi hóa học và vật lý để trả lời câu hỏi.
Lời giải chi tiết:
- Hình mô tả hiện tượng chất bị biến đổi thành chất khác:
d) Đốt mẩu giấy vụn.
e) Đun đường.
g) Đinh sắt bị gỉ.
- Hình chỉ mô tả sự thay đổi về tính chất vật lí (trạng thái, kích thước, hình dạng, ….):
a) Xé mẩu giấy vụn.
b) Hoà tan đường vào nước.
c) Đinh sắt bị uốn cong.
CH tr 12 CH1
: Vẽ sơ đồ bằng chữ mô tả quá trình (sự thay đổi về trạng thái, kích thước, …) và hiện tượng ở thí nghiệm 1 (thể hiện tính chất vật lí của muối ăn).
Phương pháp giải:
Dựa vào quá trình biến đổi vật lí trả lời câu hỏi

CH tr 13 LT1
Trong các quá trình được mô tả ở hình 1.1, quá trình nào diễn ra sự biến đổi vật lí? Giải thích.
Phương pháp giải:
Dựa vào hình 1.1 SGK trang 12 trả lời câu hỏi
Lời giải chi tiết:
Các quá trình vật lí trong hình 1.1 là:
a) Xé mẩu giấy vụn: Quá trình này là quá trình vật lí do chỉ có sự thay đổi kích thước, số lượng mầu giấy, không có sự tạo thành chất mới.
b) Hoà tan đường vào nước: Quá trình này là quá trình vật lí do có sự thay đổi trạng thái của đường (từ rắn sang lỏng), không có sự tạo thành chất mới.
c) Đinh sắt bị uốn cong: Quá trình này là quá trình vật lí do chỉ có sự thay đổi về hình dạng, không có sự tạo thành chất mới.
CH tr 13 VD1
Kể thêm 2 – 3 hiện tượng xảy ra trong thực tế có sự biến đổi vật lí.
Phương pháp giải:
Dựa vào những hiểu biết của em và những biến đổi vật lí ngoài đời sống để trả lời câu hỏi.
Lời giải chi tiết:
Một số hiện tượng vật lí trong thực tế:
+ Khi nước được đưa vào ngăn làm đá của tủ lạnh, nước lỏng chuyển thành nước đá.
+ Thuỷ tinh nóng chảy được thổi thành bình cầu.
+ Uốn cong thanh sắt.
CH tr 14 VD2
Kể thêm 2 – 3 hiện tượng xảy ra trong thực tế có sự biến đổi hoá học.
Phương pháp giải:
Dựa vào hiểu biết của em và quan sát những biến đổi hóa học ngoài đời sống.
Lời giải chi tiết:
Một số hiện tượng xảy ra trong thực tế có sự biến đổi hoá học là:
+ Đốt cháy than để đun nấu.
+ Dây xích xe đạp bị gỉ do tiếp xúc với oxygen và hơi nước có trong không khí.
+ Tượng đá bị hư hại do mưa acid.
+ Xăng cháy trong động cơ xe máy.
CH tr 14 LT2
Trong các quá trình được mô tả ở hình 1.1, quá trình nào diễn ra sự biến đổi hoá học? Giải thích.
Phương pháp giải:
Dựa vào hình 1.1 sách giáo khoa trang 12 để trả lời câu hỏi
Lời giải chi tiết:
Trong các quá trình được mô tả ở hình 1.1, quá trình diễn ra sự biến đổi hoá học:
d) Đốt mẩu giấy vụn: Quá trình này là quá trình hoá học do sau khi đốt, mẩu giấy vụn đã bị biến đổi tạo thành chất khác.
e) Đun đường: Quá trình này là quá trình hoá học do sau khi đun, đường đã bị biến đổi thành chất khác (màu đen, mùi khét…)
g) Đinh sắt bị gỉ: Quá trình này là quá trình hoá học do phần sắt gỉ đã biến đổi thành chất khác, không còn những đặc tính của sắt ban đầu.
CH tr 14 CH2
Trong thí nghiệm 3, dấu hiệu nào dùng để phân biệt sự biến đổi vật lí và sự biến đổi hoá học?
Phương pháp giải:
Dựa vào thí nghiệm và kiến thức đã học về biến đổi tính chất vật lí để trả lời câu hỏi.
Lời giải chi tiết:
Hướng dẫn giải:
Trong thí nghiệm 3, dấu hiệu dùng để phân biệt sự biến đổi vật lí và sự biến đổi hoá học là sự tạo thành chất mới.
+ Sự biến đổi vật lí: không tạo thành chất mới.
+ Sự biến đổi hoá học: có sự tạo thành chất mới.
CH tr 14 LT3
Quan sát hình 1.3 và cho biết quá trình nào diễn ra sự biến đổi vật lí, quá trình nào diễn ra sự biến đổi hoá học.
Phương pháp giải:
Dựa vào hình 1.3 SGK trang 14 để trả lời câu hỏi
Lời giải chi tiết:
+ Quá trình diễn ra sự biến đổi vật lí: b và d.
+ Quá trình diễn ra sự biến đổi hoá học: a và c.
CH tr 14 LT4
Nêu những điểm khác nhau giữa sự biến đổi vật lí và sự biến đổi hoá học.
Phương pháp giải:
Dựa vào kiến thức đã học về biến đổi vật lí và biến đổi hóa học để trả lời câu hỏi.
Lời giải chi tiết:
Điểm khác nhau giữa sự biến đổi vật lí và sự biến đổi hoá học:
+ Biến đổi vật lí: chất có sự biến đổi về trạng thái, kích thước, … nhưng vẫn giữ nguyên là chất ban đầu.
+ Biến đổi hoá học: chất có sự biến đổi tạo ra chất khác.
CH tr 15 VD3
Trong các trường hợp dưới đây, trường hợp nào diễn ra sự biến đổi vật lí, trường hợp nào diễn ra sự biến đổi hoá học?
a) Khi có dòng điện đi qua, dây tóc bóng đèn (làm bằng kim loại tungsten) nóng và sáng lên.
b) Hiện tượng băng tan.
c) Thức ăn bị ôi thiu.
d) Đốt cháy khí methane (CH4) thu được khí carbon dioxide (CO2) và hơi nước (H2O).
Phương pháp giải:
Dựa vào kiến thức đã học về biến đổi hóa học và biến đổi vật lí để trả lời câu hỏi.
Lời giải chi tiết:
+ Trường hợp a và b diễn ra sự biến đổi vật lí do không có sự tạo thành chất mới.
+ Trường hợp c và d diễn ra sự biến đổi hoá học do có sự tạo thành chất mới.
Lý thuyết
>> Xem chi tiết: Lý thuyết Biến đổi vật lí và biến đổi hóa học - Khoa học tự nhiên 8 Cánh diều
CH tr 46 BT1
a) Hiện nay, gas thường được dùng làm nhiên liệu để đun nấu, quá trình nào có sự biến đổi hoá học xảy ra trong các quá trình diễn ra dưới đây?
(1) Các khí (chủ yếu là butane và propane) được nén ở áp suất cao, hoá lỏng và tích trữ ở bình gas.
(2) Khi mở khoá bình gas, gas lỏng trong bình chuyển lại thành khí.
(3) Gas bắt lửa và cháy trong không khí chủ yếu tạo thành khí carbon dioxide và nước.
b) Gas thường rất dễ bắt cháy lại không mùi lên rất nguy hiểm nếu bị rò gỉ. Để dễ nhận biết, các nhà sản xuất thường bổ sung một khí có mùi vào bình gas. Theo em, cần làm gì nếu ngửi thấy có mùi gas trong nhà?
Phương pháp giải:
Dựa vào kiến thức đã được học về biến đổi hóa học và vật lí để trả lời câu hỏi
Lời giải chi tiết:
a) Quá trình có xảy ra sự biến đổi hoá học:
(3) Gas bắt lửa và cháy trong không khí chủ yếu tạo thành khí carbon dioxide và nước.
b) Nếu ngửi thấy mùi gas trong nhà, chứng tỏ đã có khí gas rò gỉ. Do đó cần phải tiến hành theo các bước sau:
Bước 1: Khóa van bình gas để tránh gas thoát ra nhiều có thể dẫn đến cháy nổ cao.
Bước 2: Mở hết tất cả các cửa (cửa sổ, cửa ra vào …) để khí gas thoát ra ngoài
Chú ý: Có thể sử dụng bìa carton hoặc quạt tay để lùa khí gas ra môi trường nhưng không được bật quạt điện hoặc bật/tắt các công tắc, thiết bị điện, dùng diêm hay bật lửa … trong nhà bởi dễ phát ra tia lửa điện gây cháy một cách dễ dàng.
Bước 3: Thông báo đến các thành viên đang có trong nhà, di dời trẻ em, người già ra khỏi nhà và báo người lớn (bố, mẹ, …) để có biện pháp xử lí phù hợp tiếp theo.
CH tr 46 BT2
Đốt cháy hoàn toàn 9 gam kim loại magnesium trong oxygen thu được 15 gam magnesium oxide.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Viết phương trình bảo toàn khối lượng của các chất trong phản ứng.
c) Tính khối lượng oxygen đã phản ứng.
Phương pháp giải:
Dựa vào cách viết phương trình hóa học, tính theo phương trình hóa học và cách tính số mol của nguyên tử, phân tử.
n = m : M
Lời giải chi tiết:
a) Phương trình hoá học của phản ứng:
2Mg + O2 → 2MgO.
b) Phương trình bảo toàn khối lượng của các chất trong phản ứng:
m Mg + m O2 = m MgO
c) Khối lượng oxygen đã phản ứng là:
mO2 = mMgO – mMg = 15 – 9 = 6 (gam).
CH tr 46 BT3
a) Na + O2 → Na2O
b) P2O5 + H2O → H3PO4
c) Fe(OH)3 → Fe2O3 + H2O
d) Na2CO3 + CaCl2 → CaCO3↓ + NaCl
Lập phương trình hoá học và cho biết tỉ lệ số nguyên tử/ số phân tử của các chất trong mỗi phản ứng.
Phương pháp giải:
Dựa vào cách viết phương trình hóa học để hoàn thiện sơ đồ phản ứng
Lời giải chi tiết:
a) 4Na + O2 → 2Na2O
Tỉ lệ:
Số nguyên tử Na : Số phân tử O2 : Số phân tử Na2O = 4 : 1 : 2.
b) P2O5 + 3H2O → 2H3PO4
Tỉ lệ:
Số phân tử P2O5 : Số phân tử H2O : Số phân tử H3PO4 = 1 : 3 : 2.
c) 2Fe(OH)3 → Fe2O3 + 3H2O
Tỉ lệ:
Số phân tử Fe(OH)3 : Số phân tử Fe2O3 : Số phân tử nước = 2 : 1 : 3.
d) Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl
Tỉ lệ:
Số phân tử Na2CO3 : Số phân tử CaCl2 : Số phân tử CaCO3 : Số phân tử NaCl = 1 : 1 : 1 : 2.
CH tr 46 BT4
Khí A có tỉ khối đối với H2 là 22.
a) Tính khối lượng mol khí A.
b) Một phân tử khí A gồm 1 nguyên tử nguyên tố X liên kết với 2 nguyên tử oxygen. Xác định công thức hoá học của phân tử khí A.
Phương pháp giải:
Dựa vào công thức tính tỉ khối của 2 chất khi A và B
d A/B = MA : MB
Lời giải chi tiết:
a) Khối lượng mol khí A:
dA/H2 = = 22 ⇒ MA = 22 × MH2 = 22 × 2 = 44 (g/mol).
b) Công thức hoá học của khí A có dạng: XO2.
Ta có: MX + 2 × MO = 44 ⇒ MX = 12.
Vậy X là carbon (C).
Công thức hoá học khí A là: CO2.
CH tr 46 BT5
Đồ thị hình 1 biểu thị sự phụ thuộc của độ tan (S) của các chất (a), (b), (c) và (d) theo nhiệt độ (toC).
a) Các chất có độ tan tăng theo nhiệt độ là
A. (a), (b), (c). B. (b), (c), (d).
C. (a), (c), (d). D. (a), (b), (d).
b) Ở 30 oC, chất có độ tan lớn nhất là
A. (a). B. (b).
C. (c). D. (d).
c) Chất có độ tan giảm khi nhiệt độ tăng là
A. (d). B. (c).
C. (b). D. (a).
Phương pháp giải:
Quan sát hình 1 để trả lời câu hỏi.
Lời giải chi tiết:
a) Đáp án đúng là: C
Các chất có đồ thị hướng lên trên là a, c, d Þ Các chất này có độ tan tăng theo nhiệt độ.
b) Đáp án đúng là: D
Dựa vào đồ thị xác định được, ở 30 oC chất có độ tan lớn nhất là d.
c) Đáp án đúng là: C
Chất có độ tan giảm khi nhiệt độ tăng là b (do đồ thị hướng xuống).
CH tr 46 BT6
Viết công thức hoá học của hai chất khí nhẹ hơn không khí, hai chất khí nặng hơn không khí.
Phương pháp giải:
Dựa vào công thức tính tỉ khối của chất khi
d A/B = MA : MB
Lời giải chi tiết:
- Hai chất khí nhẹ hơn không khí là: H2 (M = 2 g/ mol) và He (M = 4 g/ mol).
- Hai chất khí nặng hơn không khí là: CO2 (M = 44 g/ mol) và SO2 (M = 64 g/ mol).
CH tr 46 BT7
Có hai ống nghiệm, mỗi ống đều chứa một mẩu đá vôi (thành phần chính là CaCO3) có kích thước tương tự nhau. Sau đó, cho vào mỗi ống khoảng 5 ml dung dịch HCl có nồng độ lần lượt là 5% và 15%.
a) Viết phương trình hoá học của phản ứng, biết rằng sản phẩm tạo thành gồm: CaCl2, CO2 và H2O.
b) Ở ống nghiệm nào phản ứng hoá học sẽ xảy ra nhanh hơn? Giải thích.
Phương pháp giải:
Dựa vào cách viết phương trình hóa học và các yếu tó ảnh hưởng đến tốc độ phản ứng.
Nồng độ càng cao thì tốc độ xảy ra phản ứng hóa học càng nhanh
Lời giải chi tiết:
a) Phương trình hoá học của phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
b) Ở ống nghiệm chứa HCl 15% phản ứng sẽ xảy ra nhanh hơn. Do nồng độ các chất càng lớn, tốc độ phản ứng xảy ra càng nhanh.
CH tr 41 MĐ
Tiến hành thí nghiệm sau để tìm hiểu về tốc độ của phản ứng hoá học:
Thí nghiệm 1
Cho một thìa thuỷ tinh bột đá vôi và một mẩu đá vôi nhỏ có khối lượng bằng nhau lần lượt vào hai ống nghiệm 1 và 2, sau đó cho đồng thời vào mỗi ống nghiệm khoảng 5 ml dung dịch HCl cùng nồng độ. Quan sát hiện tượng xảy ra ở hai ống nghiệm và trả lời các câu hỏi sau:
a) So sánh tốc độ tan của đá vôi trong dung dịch acid ở cả hai ống nghiệm.
b) Dựa vào đâu để kết luận phản ứng nào xảy ra nhanh hơn?
Phương pháp giải:
Lời giải chi tiết:
a) Đá vôi dạng bột (trong ống nghiệm 1) tan nhanh hơn đá vôi dạng viên (trong ống nghiệm 2).
b) Dựa vào tốc độ tan của đá vôi trong dung dịch acid để kết luận phản ứng nào xảy ra nhanh hơn.
CH tr 41 CH1
Quan sát hình 7.1 và cho biết phản ứng nào xảy ra nhanh hơn, phản ứng nào xảy ra chậm hơn.
Phương pháp giải:
Dựa vào hình 7.1 để trả lời câu hỏi
Lời giải chi tiết:
Phản ứng đốt cháy cồn xảy ra nhanh hơn sự gỉ của sắt.
CH tr 42 LT1
Trường hợp nào có phản ứng xảy ra với tốc độ nhanh hơn trong hai trường hợp sau:
a) Để que đóm còn tàn đỏ ở ngoài không khí.
b) Đưa que đóm còn tàn đỏ vào bình chứa khí oxygen.
Phương pháp giải:
Dựa vào khái niệm tốc độ phản ứng: tốc độ phản ứng là đại lượng chỉ mức độ nhanh hay chậm của 1 phản ứng hóa học
Lời giải chi tiết:
Trường hợp (b) Đưa que đóm còn tàn đỏ vào bình chứa khí oxygen có phản ứng xảy ra với tốc độ nhanh hơn.
CH tr 42 VD1
Trong hai phản ứng sau, phản ứng nào có tốc độ nhanh hơn, phản ứng nào có tốc độ chậm hơn?
a) Đốt cháy dây sắt trong oxygen.
b) Sự gỉ sắt trong không khí.
Phương pháp giải:
Dựa cào các yếu tố ảnh hưởng đến tốc độ phản ứng:
Nhiệt độ càng cao thì tốc độ phản ứng xảy ra càng nhanh
Lời giải chi tiết:
Phản ứng (a) có tốc độ nhanh hơn phản ứng (b).
CH tr 42 VD2
Kể thêm hai phản ứng, một phản ứng có tốc độ nhanh và một phản ứng có tốc độ chậm trong thực tế.
Phương pháp giải:
Dựa vào hiểu biết của em và kiến thức được học về tốc độ phản ứng
Lời giải chi tiết:
- Phản ứng có tốc độ nhanh: Phản ứng đốt cháy khí gas dùng trong đun nấu.
- Phản ứng có tốc độ chậm: Phản ứng lên men giấm.
CH tr 42 LT2
Cho cùng một lượng Zn hạt và Zn bột vào hai ống nghiệm 1 và 2. Sau đó, cho cùng một thể tích dung dịch HCl dư cùng nồng độ vào hai ống nghiệm. Dự đoán lượng Zn ở ống nghiệm nào sẽ tan hết trước.
Phương pháp giải:
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng trong đó có ảnh hưởng của diện tich tiếp xúc và nồng độ chất tham gia phản ứng
Lời giải chi tiết:
Dự đoán Zn ở ống nghiệm 2 (Zn dạng bột) sẽ tan hết trước do diện tích tiếp xúc với dung dịch HCl của Zn dạng bột lớn hơn của Zn dạng hạt.
CH tr 42 VD3
Nêu ví dụ trong thực tiễn có vận dụng yếu tố ảnh hưởng của diện tích bề mặt tiếp xúc đến tốc độ của phản ứng.
Phương pháp giải:
Dựa vào các ví dụ và kiến thức của em về yếu tố ảnh hưởng đến tốc độ phản ứng
Lời giải chi tiết:
Một số ví dụ:
- Tạo các hàng lỗ trong viên than tổ ong để tăng diện tích tiếp xúc giữa than và không khí, cung cấp đủ oxygen cho quá trình cháy.
- Để nung đá vôi thành vôi sống được nhanh hơn, người ta tiến hành đập nhỏ đá vôi.
- Thanh củi được chẻ nhỏ hoặc than được đập nhỏ trước khi đem nhóm bếp.
CH tr 43 LT3
Cho hai cốc thuỷ tinh đựng nước lạnh và nước nóng, thả đồng thời vào mỗi cốc một viên vitamin C (dạng sủi). Dự đoán xem ở cốc nào viên vitamin C tan nhanh hơn.
Phương pháp giải:
Dựa vào yếu tố nhiệt độ ảnh hưởng đến tốc độ phản ứng: nhiệt độ càng cao thì tốc độ phản ứng càng nhanh
Lời giải chi tiết:
Khi tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn.
Dự đoán ở cốc nước nóng viên vitamin C tan nhanh hơn.
CH tr 43 VD4
Tại sao trên các tàu đánh cá, ngư dân phải chuẩn bị những hầm chứa đá lạnh để bảo quản cá?
Phương pháp giải:
Yếu tố nhiệt độ ảnh hưởng đến tốc độ phản ứng, nhiệt độ càng cao thì thời gian phân hủy của cá càng nhanh.
Lời giải chi tiết:
Hải sản sau khi đánh bắt trên tàu, thuyền cần được bảo quản để tránh hư hỏng, thối rữa gây giảm năng suất trong khi đợi đưa về đất liền để tiêu thụ. Do đó, trên các tàu đánh cá, ngư dân phải chuẩn bị những hầm chứa đá lạnh để bảo quản cá bằng cách ướp lạnh, giúp cá tươi lâu, làm chậm quá trình hư hỏng, phân huỷ cá…
CH tr 44 LT4
Đề xuất thí nghiệm cho đá vôi tác dụng với dung dịch HCl để chứng minh nồng độ có ảnh hưởng đến tốc độ phản ứng.
Phương pháp giải:
Dựa vào yếu tố nồng độ ảnh hưởng đến tốc độ phản ứng
Lời giải chi tiết:
Đề xuất thí nghiệm:
Chuẩn bị:
- Dụng cụ: Ống nghiệm, giá để ống nghiệm, ống hút nhỏ giọt.
- Hoá chất: Đá vôi dạng bột, dung dịch HCl 1 M; dung dịch HCl 2 M.
Tiến hành:
- Cho lần lượt 1 gam đá vôi dạng bột vào ống nghiệm 1 và 2.
- Sau đó, cho vào ống nghiệm 1 khoảng 5 mL HCl 1 M; cho vào ống nghiệm 2 khoảng 5 mL dung dịch HCl 2 M.
- Ghi lại thời gian bột đá vôi tan hết ở mỗi ống nghiệm (hoặc so sánh tốc độ thoát khí ở mỗi ống nghiệm) và rút ra nhận xét về ảnh hưởng của nồng độ đến tốc độ phản ứng
CH tr 45 CH2
Trong thí nghiệm 4, cho biết MnO2 làm thay đổi tốc độ phản ứng như thế nào.
Phương pháp giải:
Dựa vào yếu tố chất xúc tác làm ảnh hưởng đến tốc độ phản ứng.
Lời giải chi tiết:
Trong thí nghiệm 4, MnO2 làm tăng tốc độ phản ứng.
CH tr 45 LT5
Khi điều chế oxygen trong phòng thí nghiệm từ KClO3, phản ứng xảy ra nhanh hơn khi có MnO2. Cho biết vai trò của MnO2 trong phản ứng này.
Phương pháp giải:
Dựa vào yếu tố chất xúc tác làm ảnh hưởng đến tốc độ phản ứng
Lời giải chi tiết:
MnO2 là chất xúc tác cho phản ứng điều chế oxygen từ KClO3.
Lý thuyết
>> Xem chi tiết: Lý thuyết Tốc độ phản ứng và chất xúc tác - Khoa học tự nhiên 8 Cánh diều
CH tr 36 MĐ
Khi hoà chất rắn vào nước, có chất tan nhiều, có chất tan ít, có chất không tan trong nước. Làm thế nào để so sánh khả năng hoà tan trong nước của các chất và xác định khối lượng chất tan có trong một dung dịch?
Phương pháp giải:
Lời giải chi tiết:
- Để so sánh khả năng hoà tan trong nước của các chất ta dựa vào độ tan của từng chất trong nước.
- Để xác định khối lượng chất tan trong một dung dịch có nhiều cách, như:
+ Dựa vào khối lượng dung dịch và khối lượng dung môi:
m chất tan = m dung dịch – m dung môi
Dựa vào nồng độ phần tram và khối lượng dung dịch:
m chất tan = (C% x m dd) : 100
+ Dựa vào nồng độ mol, thể tích dung dịch và khối lượng mol chất tan.
n = CM : V (mol); m = n x M (gam)
CH tr 36 CH1
Dung dịch bão hoà là gì?
Phương pháp giải:
Dựa vào kiến thức đã được học về dung dịch để trả lời câu hỏi
Lời giải chi tiết:
Dung dịch không thể hoà tan thêm chất tan được nữa gọi là dung dịch bão hoà.
CH tr 36 CH2
Tính khối lượng sodium chloride cần hoà tan trong 200 gam nước ở 20 oC để thu được dung dịch sodium chloride bão hoà.
Phương pháp giải:
Dựa vào công thức tính độ tan của 1 chất ở nhiệt độ xác định:
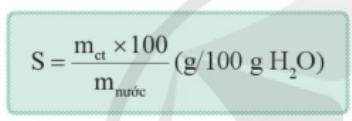
Trong đó mct là khối lượng của chất tan được hòa tan trong nước tạo thành dung dịch bão hòa, có đơn vị là gam.
m nước là khối lượng nước, có đơn vị là gam.
Lời giải chi tiết:

CH tr 37 LT2
a) Có thể hoà tan tối đa bao nhiêu gam đường ăn trong 250 gam nước ở 30 oC?
b) Có thể hoà tan tối đa bao nhiêu gam đường ăn trong 250 gam nước ở 60 oC?
Phương pháp giải:
Dựa vào công thức tính độ tan của 1 chất ở nhiệt độ xác định
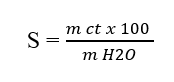
Lời giải chi tiết:
a) ở 60oC có thể hoà tan (288,8 x 250) / 100 = 722 gam đường
b) ở 30oC có thể hoà tan (216,7 x 250) / 100 = 541,75 gam đường
CH tr 38 VD1
Dung dịch D – glucose 5% được sử dụng trong y tế làm dịch truyền, nhằm cung cấp nước và năng lượng cho bệnh nhân bị suy nhược cơ thể hoặc sau phẫu thuật. Biết trong một chai dịch truyền có chứa 25 gam đường D – glucose. Tính lượng dung dịch và lượng nước có trong chai dịch truyền đó.
Phương pháp giải:
Dựa vào công thức tính
C% = (mct : m dd) x 100
Lời giải chi tiết:
Khối lượng dung dịch có trong chai truyền là:
C% = (mct : m dd) x 100
⇨ m dung dịch = (25 x 100) : 5 = 500 gam
Khối lượng nước có trong chai dịch truyền là: 500 – 25 = 475 (gam)
CH tr 38 VD2
Từ sodium chloride, nước và những dụng cụ cần thiết, nêu cách pha 500 gam dung dịch sodium chloride 0,9%.
Phương pháp giải:
Dựa vào kiến thức đã được học về pha loãng dung dịch
Lời giải chi tiết:
Tính toán trước pha chế:
Khối lượng NaCl cần dùng để pha chế là:
m NaCl = (500 x 0,9) : 100 = 4,5 (gam)
Khối lượng nước cần dùng để pha chế là:
mnước = mdung dịch - mchất tan = 500 – 4,5 = 495,5 (g)
Cách pha chế
Chuẩn bị:
- Dụng cụ: Cân điện tử, cốc thuỷ tinh (loại 1000 mL), đũa thuỷ tinh.
- Hoá chất: Muối ăn (sodium chloride), nước cất.
Tiến hành:
Bước 1: Cân chính xác 4,5 gam muối ăn cho vào cốc dung tích 1000 mL.
Bước 2: Cân lấy 495,5 gam nước cất, rồi cho dần vào cốc và khấy nhẹ cho tới khi thu được 500 gam dung dịch sodium chloride 0,9%.
CH tr 39 LT3
Tính số gam chất tan cần để pha chế 100 ml dung dịch CuSO4 0,1 M.
Phương pháp giải:
Dựa vào công thức tính nồng độ mol dung dịch: CM = n : V
Lời giải chi tiết:
Đổi 100 mL = 0,1 lít.
Số mol chất tan có trong dung dịch là:
nCuSO4 = CM × V= 0,1 × 0,1= 0,01(mol).
Khối lượng chất tan cần dùng để pha chế là:
mCuSO4=n × M = 0,01 × (64 + 32 + 16 × 4) = 1,6 (gam).
CH tr 32 MĐ
Trong công nghiệp, người ta sản xuất nhôm từ aluminium oxide (Al2O3). Làm thế nào tính được khối lượng nguyên liệu cần dùng để sản xuất nhôm hoặc tính khối lượng nhôm tạo ra nếu biết khối lượng nguyên liệu đã dùng?
Phương pháp giải:
Lời giải chi tiết:
Dựa vào khối lượng nguyên liệu đã dùng, hiệu suất phản ứng và phương trình hoá học có thể tính được khối lượng nguyên liệu cần dùng để sản xuất nhôm hoặc tính khối lượng nhôm tạo ra.
CH tr 33 LT1
Đốt cháy hết 0,54 gam Al trong không khí thu được aluminium oxide theo sơ đồ phản ứng: Al + O2 → Al2O3
Lập phương trình hoá học của phản ứng rồi tính:
a) Khối lượng aluminium oxide tạo ra.
b) Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn.
Phương pháp giải:
Dựa vào cách xác định khối lượng, số mol của chất phản ứng và sản phẩm trong phản ứng hóa học.
Lời giải chi tiết:
Phương trình hoá học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
n Al = mAl : M Al = 0,54 : 27 = 0,02 mol
a) Từ phương trình hóa học ta có:
n Al2O3 = ½ n Al = 0,02 : 2 = 0,01 mol
n Al2O3 = 0,01 x 102 = 1,02 gam
b) theo phương trình hóa học ta có:
n O2 = ¾ n Al = ¾ x 0,02 = 0,015 mol
V O2 (đkc) = 0,015 x 24,79 = 0,37185 (lít)
CH tr 33 CH1
Đốt cháy 1 mol khí hydrogen trong 0,4 mol khí oxygen đến khi phản ứng xảy ra hoàn toàn. Cho biết chất nào còn dư sau phản ứng.
Phương pháp giải:
Dựa vào cách xác định số mol, tính theo phương trình hóa học
Lời giải chi tiết:
Phương trình hoá học: 2H2 + O2 → 2H2O
Tỉ lệ số phân tử: 2 1 2
Ban đầu: 1 0,4 0 mol
Phản ứng: 0,8 0,4 0,8 mol
Sau phản ứng: 0,2 0 0,8 mol
Vậy sau phản ứng H2 dư 0,2 mol.
CH tr 34 CH2
a) Hiệu suất phản ứng được tính bằng cách nào?
b) Khi nào hiệu suất của phản ứng bằng 100%?
Phương pháp giải:
Dựa vào phần hiệu suất phản ứng SGK Tr 34 để trả lời câu hỏi
Lời giải chi tiết:
a) Thông thường, hiệu suất phản ứng biểu thị theo phần trăm và được tính theo biểu thức sau:
H = (mtt x 100) / mlt (%)
Trong đó:
mtt là khối lượng chất (g) thu được theo thực tế.
mlt là khối lượng chất (g) thu được theo lí thuyết (tính theo phương trình).
H là hiệu suất phản ứng (%).
b) Hiệu suất phản ứng là 100% tức là phản ứng hoá học xảy ra hoàn toàn.
CH tr 27 MĐ
Nếu yêu cầu đếm số lượng viên gạch để xây bức tường của lâu đài (hình 4.1) và đếm số lượng hạt cát để xây bức tường của lâu đài bằng cát (hình 4.2), yêu cầu nào có thể thực hiện được? Vì sao?
Với những vật thể có kích thước và khối lượng đáng kể như viên gạch, quả táo, …, người ta dễ dàng xác định số lượng, khối lượng và thể tích của chúng bằng cách đếm, cân, đo, … Nhưng với những hạt có kích thước vô cùng nhỏ bé như nguyên tử, phân tử rất khó có thể cân và đếm được chúng.
Vậy làm thế nào để có thể xác định một cách thuận lợi số nguyên tử, phân tử và khối lượng, thể tích của chúng khi tham gia và tạo thành trong các phản ứng hoá học?
Phương pháp giải:
Lời giải chi tiết:
Yêu cầu đếm số viên gạch để xây bức tường của lâu đài dễ dàng thực hiện hơn vì viên gạch là vật thể có kích thước và khối lượng đáng kể người ta sẽ có thể xác định được số lượng còn hạt cát thì là những vật có kích thước vô cùng nhỏ bé nhưng khó cân đo đong đếm
Để có thể xác định một cách thuận lợi số nguyên tử, phân tử và khối lượng, thể tích của chúng khi tham gia và tạo thành trong các phản ứng hoá học các nhà khoa học sử dụng đại lượng mol
CH tr 27 CH1
Xác định số nguyên tử có trong:
a) 2 mol nguyên tử nhôm (aluminium).
b) 1,5 mol nguyên tử carbon.
Phương pháp giải:
Mol là lượng chất có chứa 6,022 × 1023 hạt vi mô (nguyên tử, phân tử, …) của chất đó.
Lời giải chi tiết:
a) Số nguyên tử có trong 2 mol nguyên tử nhôm (aluminium):
2 × 6,022 × 1023 = 1,2044 × 1024 (nguyên tử).
b) Số nguyên tử có trong 1,5 mol nguyên tử carbon:
1,5 × 6,022 × 1023 = 9,033 × 1023 (nguyên tử).
CH tr 28 LT1
Tính số phân tử nước và số nguyên tử của mỗi nguyên tố có trong 3 mol phân tử nước.
Phương pháp giải:
Mol là lượng chất có chứa 6,022 × 1023 hạt vi mô (nguyên tử, phân tử, …)
Lời giải chi tiết:
- 3 mol phân tử nước chứa số phân tử nước là:
3 × 6,022 × 1023 = 1,8066 × 1024 (phân tử).
- Cứ 1 phân tử nước chứa 2 nguyên tử hydrogen và 1 nguyên tử oxygen.
Vậy 3 mol phân tử nước chứa:
+ Số nguyên tử hydrogen là: 2 × 1,8066 × 1024 = 3,6132 × 1024 (nguyên tử).
+ Số nguyên tử oxygen là: 1 × 1,8066 × 1024 = 1,8066 × 1024 (nguyên tử).
CH tr 28 CH2
Quan sát hình 4.3, cho biết khối lượng 1 mol nguyên tử đồng và khối lượng 1 mol phân tử sodium chloride.
Phương pháp giải:
Dựa vào khái niệm về khối lương MOL để trả lời câu hỏi
Lời giải chi tiết:
Khối lượng 1 mol nguyên tử đồng là 64 gam
Khối lượng 1 mol phân tử Sodium chloride là 58,5 gam
CH tr 28 CH3
Dựa vào bảng tuần hoàn các nguyên tố hoá học, cho biết khối lượng mol nguyên tử hydrogen, nitơ (nitrogen) và magnesium
Phương pháp giải:
Dựa vào bảng tuần hoàn hóa học để trả lời câu hỏi
Lời giải chi tiết:
Dựa vào bảng tuần hoàn:
- Khối lượng mol nguyên tử hydrogen là: 1,008 gam/ mol.
- Khối lượng mol nguyên tử nitơ (nitrogen) là: 14,01 gam/ mol.
- Khối lượng mol nguyên tử magnesium là: 24,31 gam/ mol.
CH tr 28 LT2
Tính khối lượng mol phân tử khí oxygen và khí carbon dioxide.
Phương pháp giải: Khối lượng mol phân tử của một chất có cùng trị số với khối lượng phân tử chất đó tính theo đơn vị amu
Phương pháp giải:
Dựa vào công thức tính khối lượng mol phân tử để trả lời câu hỏi.
Khối lượng mol là khối lượng tính bằng gam của N phân tử hoặc nguyên tử chất đó.
Lời giải chi tiết:
Khối lượng mol phân tử khí oxygen là: 16 × 2 = 32 (gam/ mol).
Khối lượng mol phân tử của khí carbon dioxide là: 12 + 16 x 2 = 44 (gam/mol)
CH tr 29 CH3
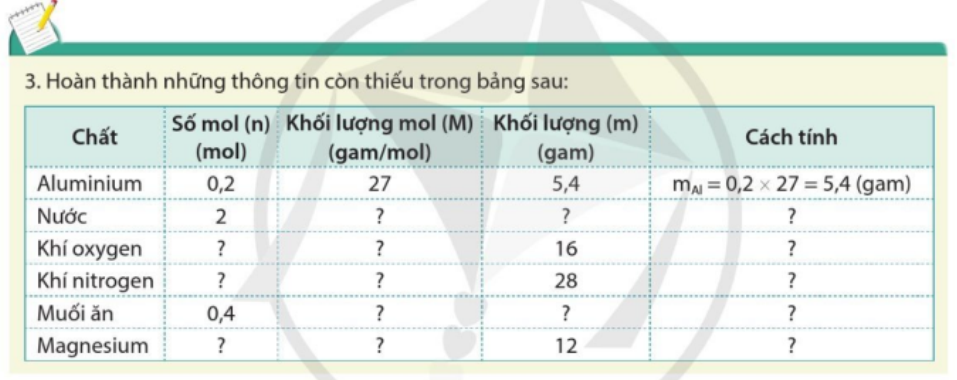
Phương pháp giải:
Áp dụng công thức:
n = m : M (mol) 🡺 m = n : M (gam); M = m : n (gam/mol)
V = n x 24,79 (lít) 🡪 n = V : 24,79 (mol)
Lời giải chi tiết:
Chất
Số mol (n) (mol)
Khối lượng mol (M) (gam/mol)
Khối lượng (m) (gam)
Cách tính
Aluminium
0,2
27
5,4
m Al = 0,2.27 = 5,4 gam
Nước
2
18
36
m H2O = 2.18 = 36 gam
Khí oxygen
0,5
32
16
n O2 = 16 : 32 = 0,5 mol
Khí nitrogen
2
14
28
n N2 = 28 : 14 = 2 mol
Muối ăn
0,4
58,5
23,4
m NaCl = 0,4.58,5 = 23,4g
Magnesium
1
12
12
n Mg = 12 : 12 = 1 mol
CH tr 29 CH
Quan sát hình 4.4, cho biết ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25C) thể tích 1 mol khí là bao nhiêu.
Phương pháp giải:
Dựa vào hình 4.4
Lời giải chi tiết:
Thể tích mol của một số khí ở 25C, 1 bar bằng 24,79L
CH tr 30 LT
Hoàn thành những thông tin còn thiếu trong bảng sau:

Phương pháp giải:
dựa vào công thức tính M, n, m, V
Lời giải chi tiết:
Chất
Các đại lượng (đơn vị)
M (g/mol)
n (mol)
m (g)
V (l) (đkc)
CO2
44
0,4
17,6
9,916
N2
28
0,2
5,6
4,958
H2
2
0,5
1
12,395
CH tr 30 CH5
Nếu không dùng cân, làm thế nào có thể biết được 24,79 lít khí N2 nặng hơn 24,79 lít khí H2 bao nhiêu lần (ở cùng điều kiện nhiệt độ, áp suất)?
Phương pháp giải:
Dựa vào công thức tỉ khối của chất A so với chất B
dA/B = MA : MB
Lời giải chi tiết:
Để so sánh khí N2 nặng hơn khí H2 bao nhiêu lần (ở cùng điều kiện nhiệt độ, áp suất) mà không dùng cân người ta so sánh khối lượng mol của hai khí đó.
CH tr 30 CH6
Làm thế nào để biết khí A nặng hay nhẹ hơn khí B?
Phương pháp giải:
Dựa vào tỉ khối của chất A so với chất B.
Lời giải chi tiết:
Để so sánh khí A nặng hay nhẹ hơn khí B, người ta so sánh khối lượng của cùng một thể tích khí A và khí B trong dùng điều kiện nhiệt độ và áp suất.
CH tr 31 LT5
Có ba quả bóng bay giống nhau về kích thước và khối lượng. Lần lượt bơm cùng thể tích mỗi khí H2, CO2, O2 vào từng quả bóng bay trên. Điều gì sẽ xảy ra khi thả ba quả bóng bay đó trong không khí?
Phương pháp giải:
Dựa vào khối lượng và tỉ khối của từng chất so với không khí.
d A/kk = MA/Mkk = MA/29.
Lời giải chi tiết:
Khi thả ba quả bóng bay vào không khí chỉ có quả bóng bay chứa khí H2 là bay được lên, còn quả bóng chứa khí O2 và quả bóng chứa khí CO2 đều rơi xuống mặt đất. Do khí H2 nhẹ hơn không khí còn khí O2 và khí CO2 đều nặng hơn không khí.
CH tr 21 MĐ
Quan sát hình 3.1:
Đặt hai cây nến trên đĩa cân, cân ở vị trí thăng bằng. Nếu đốt một cây nến, sau một thời gian, cân có còn thăng bằng không? Giải thích.
Phương pháp giải:
Dựa vào hình 3.1, quan sát và vận dụng kiến thức để trả lời câu hỏi
Lời giải chi tiết:
Đặt hai cây nến trên đĩa cân, cân ở vị trí thăng bằng. Nếu đốt một cây nến, sau một thời gian, cân không còn thăng bằng. Do cây nến bị đốt đã ngắn lại và không còn nặng như ban đầu.
CH tr 21 TH1

Phương pháp giải:
Lời giải chi tiết:
- Học sinh tiến hành thí nghiệm, ghi giá trị mA và mB. Hiện tượng thí nghiệm: Xuất hiện kết tủa trắng.
- Ta có mA = mB.
Nhận xét: tổng khối lượng của các chất trước phản ứng bằng tổng khối lượng của các chất sau phản ứng.
CH tr 23 LT1
Tính khối lượng của FeS tạo thành trong phản ứng của Fe và S, biết khối lượng của Fe và S đã tham gia phản ứng lần lượt là 7 gam và 4 gam.
Phương pháp giải:
Áp dụng định luật bảo toàn khối lượng: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng cùa các chất tham gia phản ứng.
Lời giải chi tiết:
Vậy khối lượng FeS tạo thành = khối lượng Fe phản ứng + khối lượng S phản ứng
= 7 + 4 = 11 gam.
CH tr 23 VD1
Trở lại thí nghiệm trong hoạt động mở đầu: Cân có còn giữ ở vị trí thăng bằng không? Giải thích.
Phương pháp giải:
Quan sát hình 3.1 để trả lời câu hỏi
Lời giải chi tiết:
Cân không còn giữ ở trạng thái cân bằng. Do nến cháy sinh ra khí carbon dioxide và hơi nước làm cây nến ngắn dần so với ban đầu.
CH tr 23 VD2
Giải quyết tình huống:
a) Khi đốt cháy hoàn toàn một mẩu gỗ, ta thu được tro có khối lượng nhẹ hơn mẩu gỗ ban đầu. Theo em, sự thay đổi khối lượng này có mâu thuẫn với định luật bảo toàn khối lượng không?
b) Đề xuất các bước tiến hành thí nghiệm để kiểm chứng định luật bảo toàn khối lượng trong tình huống trên.
Phương pháp giải:
Vận dụng kiến thức đã được học về định luật bảo toàn khối lượng
Lời giải chi tiết:
a) Sự thay đổi khối lượng này không có mâu thuẫn với định luật bảo toàn khối lượng. Do sản phẩm thu được khi đốt cháy mẩu gỗ ngoài tro còn có carbon dioxide, hơi nước.
b) Đề xuất các bước tiến hành thí nghiệm để kiểm chứng:
Chuẩn bị:
- Dụng cụ: Cân điện tử, bật lửa.
- Hoá chất: Bình chứa khí oxygen, 1 que đóm có độ dài ngắn hơn chiều cao của bình chứa khí oxygen.
Tiến hành:
- Bước 1: Đặt bình tam giác có chứa khí oxygen và que đóm trên đĩa cân điện tử. Ghi chỉ số khối lượng hiện lên mặt cân (kí hiệu là mA).
- Bước 2: Đốt một đầu que đóm và cho nhanh vào bình chứa khí oxygen, sau đó đậy nút lại. Sau khi que đóm cháy hết hoặc dừng cháy, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mB).
- Bước 3: So sánh mA và mB, rút ra kết luận.
CH tr 24 CH1
Dựa vào kiến thức đã học, cho biết tổng số nguyên tử của mỗi nguyên tố tham gia và tạo thành sản phẩm trong ví dụ bên cần phải tuân theo nguyên tắc như thế nào?
Phương pháp giải:
Dựa vào kiến thức đã học về số lượng nguyên tử trong nguyên tố để trả lời câu hỏi
Lời giải chi tiết:
Trong phản ứng hoá học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của nguyên tố đó trong các chất sản phẩm.
CH tr 24 CH2
Cho biết số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng và các chất sản phẩm trong các ô trống trên hình 3.3.
Phương pháp giải:
Dựa vào hình 3.3 để mô tả số lượng nguyên tử và phân tử.
Lời giải chi tiết:

CH tr 25 LT2
Lập phương trình hoá học của phản ứng magnesium (Mg) tác dụng với oxygen (O2) tạo thành magnesium oxide (MgO).
Phương pháp giải:
Dựa vào các bước lập phương trình hóa học
Lời giải chi tiết:
Bước 1: Viết sơ đồ của phản ứng: Mg + O2 − − − → MgO.
Bước 2: So sánh số nguyên tử của mỗi nguyên tố có trong phân tử các chất tham gia phản ứng và các chất sản phẩm:
Mg + O2 − − − → MgO
Số nguyên tử: 1 2 1 1
Bước 3 + 4: Cân bằng số nguyên tử của mỗi nguyên tố, viết phương trình hoá học:
2Mg + O2 → 2MgO.
CH tr 25 LT3
Lập phương trình hoá học của phản ứng khi cho dung dịch sodium carbonate (Na2CO3) tác dụng với dung dịch calcium hydroxide (Ca(OH)2) tạo thành calcium carbonate (CaCO3) không tan (kết tủa) và sodium hydroxide (NaOH).
Phương pháp giải:
Dựa vào các bước lập phương trình phản ứng hóa học
Lời giải chi tiết:
Bước 1: Viết sơ đồ phản ứng
Ca(OH)2 + Na2CO3 ---> CaCO3 ↓ + NaOH
Bước 2: So sánh Số nguyên tử/nhóm nguyên tử của mỗi nguyên tố/ chất trước và sau phản ứng
Ca(OH)2 + Na2CO3 ---> CaCO3 ↓ + NaOH
Số nguyên tử/nhóm nguyên tử 1 2 2 1 1 1 1 1
Bước 3: Cân bằng Số nguyên tử/nhóm nguyên tử
Thêm hệ số 2 vào trước phân tử NaOH
Ca(OH)2 + Na2CO3 ---> CaCO3 ↓ + 2NaOH
Số nguyên tử/nhóm nguyên tử 1 2 2 1 1 1 2 2
Bước 4: Kiểm tra và viết PTHH
PTHH: Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
CH tr 26 LT4
Xét phương trình hoá học của phản ứng sau: 4Al + 3O2 → 2Al2O3
a) Cho biết số nguyên tử, số phân tử của các chất tham gia phản ứng và các chất sản phẩm.
b) Cho biết tỉ lệ hệ số của các chất trong phương trình hoá học.
Phương pháp giải:
Dựa vào phương trình hóa học và hệ số cân bằng của phản ứng hóa học để trả lời câu hỏi
Lời giải chi tiết:
a) Số nguyên tử Al : Số phân tử O2 : Số phân tử Al2O3 = 4 : 3 : 2.
b) Tỉ lệ hệ số của các chất trong phương trình hoá học = 4 : 3 : 2.
CH tr 26 VD3
Trong dạ dày người có một lượng hydrochloric acid (HCl) tương đối ổn định, có tác dụng trong tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (NaHCO3) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:
NaHCO3 + HCl → NaCl + H2O + CO2↑
Tìm hiểu và cho biết các thực phẩm có thể gây tăng lượng acid có trong dạ dày.
Phương pháp giải:
Dựa vào hiểu biết của em về thực phẩm ngoài đời sống để trả lời câu hỏi
Lời giải chi tiết:
Một số thực phẩm có thể gây tăng lượng acid có trong dạ dày
- Đồ ăn chua: Quả chua như chanh, quất … và đồ ăn lên men như dưa muối, cà muối … là những thực phẩm có lượng acid cao, khi xuống đến dạ dày có thể làm tăng lượng acid có trong dạ dày.
- Nước uống có gas: Các loại nước uống có gas phổ biến như Pepsi và Coca – cola có giá trị pH khoảng 2,5 – 3,5, do đó chúng cũng làm tăng lượng acid có trong dạ dày.
- Đồ ăn giàu chất béo: Chất béo tồn tại lâu hơn trong dạ dày và khiến tăng tiết acid dạ dày liên tục trong suốt quá trình co bóp để tiêu hóa.
- Đồ ăn cay nóng: Đồ ăn cay nóng cũng được liệt vào danh sách những thực phẩm người bị đau dạ dày không nên ăn. Gia vị cay nóng có thể khiến cho dạ dày bị tổn thương, làm tình trạng dư thừa acid dạ dày càng trở nên trầm trọng.
Ngoài ra, bia, rượu và các đồ uống có cồn cũng góp phần làm tăng lượng acid có trong dạ dày.
CH tr 16 MĐ
Tôi là Nước đây! Đố các bạn tôi được tạo thành từ nguyên tử của các nguyên tố hóa học nào? Tôi có thể được tạo thành như thế nào?
Phương pháp giải:
Dựa vào công thức cấu tạo phân tử của nước là H2O để trả lời câu hỏi
Lời giải chi tiết:
Hướng dẫn giải:
- Nước được tạo thành từ nguyên tử của các nguyên tố hydrogen và oxygen.
- Nước có thể được tạo thành từ phản ứng đốt cháy hydrogen trong oxygen.
CH tr 16 CH1
Quan sát hình 2.1, cho biết có những quá trình biến đổi hoá học nào xảy ra.
Phương pháp giải:
Dựa vào hình 2.1 để trả lời câu hỏi.
Lời giải chi tiết:
Trong hình 2.1 có những quá trình biến đổi hoá học xảy ra là:
+ Quá trình cho dung dịch HCl vào bình chứa Zn sinh ra khí H2.
+ Quá trình đốt cháy hydrogen trong bình chứa oxygen tạo thành nước (H2O).
CH tr 17 CH2
Xác định chất tham gia phản ứng và chất sản phẩm trong hai trường hợp sau:
a) Đốt cháy methane tạo thành khí carbon dioxide và nước.
b) Carbon (thành phần chính của than) cháy trong khí oxygen tạo thành khí carbon dioxide.
Phương pháp giải:
Dựa vào kiến thức về phản ứng hóa học để xác định chất tham gia phản ứng và sản phẩm.
Lời giải chi tiết:
a) Đốt cháy methane tạo thành khí carbon dioxide và nước:
+ Chất tham gia phản ứng là methane và oxygen.
+ Chất sản phẩm là carbon dioxide và nước.
b) Carbon (thành phần chính của than) cháy trong khí oxygen tạo thành khí carbon dioxide:
+ Chất tham gia phản ứng là carbon và khí oxygen.
+ Chất sản phẩm là khí carbon dioxide.
CH tr 17 CH3
Quan sát sơ đồ hình 2.2, cho biết:
a) Trước phản ứng, những nguyên tử nào liên kết với nhau?
b) Sau phản ứng, những nguyên tử nào liên kết với nhau?
c) So sánh số nguyên tử H và số nguyên tử O trước và sau phản ứng.
Phương pháp giải:
Dựa vào hình 2.2, quan sát diễn biến quá trình biến đổi để trả lời câu hỏi.
Lời giải chi tiết:
a) Trước phản ứng, 2 nguyên tử H liên kết với nhau; 2 nguyên tử O liên kết với nhau.
b) Sau phản ứng, 1 nguyên tử O liên kết với 2 nguyên tử H.
c) Số nguyên tử H và số nguyên tử O trước và sau phản ứng là bằng nhau.
CH tr 18 LT1
Đốt cháy khí methane (CH4) trong không khí thu được carbon dioxide (CO2) và nước (H2O) theo sơ đồ sau:
Quan sát sơ đồ hình 2.3 và cho biết:
a) Trước phản ứng có các chất nào, những nguyên tử nào liên kết với nhau?
b) Sau phản ứng, có các chất nào được tạo thành, những nguyên tử nào liên kết với nhau?
c) So sánh số nguyên tử C, H, O trước và sau phản ứng.
Phương pháp giải:
Dựa vào hình 2. 3 và quan sát sự biến đổi các chất trước và sau phản ứng hóa học xảy ra để trả lời câu hỏi.
Lời giải chi tiết:
a) Trước phản ứng có các chất methane (CH4) và oxygen (O2).
+ Methane (CH4) gồm 1 nguyên tử C liên kết với 4 nguyên tử H.
+ Oxygen (O2) gồm 2 nguyên tử O liên kết với nhau.
b) Sau phản ứng có các phân tử carbon dioxide (CO2) và nước (H2O) được tạo thành.
+ Carbon dioxide (CO2) gồm 1 nguyên tử C liên kết với 2 nguyên tử O.
+ Nước (H2O) gồm 2 nguyên tử H liên kết với 1 nguyên tử O.
c) Số nguyên tử C, H, O trước và sau phản ứng là bằng nhau.
CH tr 18 CH4
Chỉ ra sự khác biệt về tính chất của nước với hydrogen và oxygen mà em biết.
Phương pháp giải:
Để nhận biết phản ứng hóa học xảy ra dựa vào sự thay đổi màu sắc, mùi… của các chất tạo ra chất khí, chất không tan
Lời giải chi tiết:
Trong phản ứng giữa khí hydrogen với khí oxygen, nước tạo ra không còn tính chất của hydrogen và oxygen nữa (nước ở thể lỏng, không cháy được, …)
CH tr 18 TH1
Chuẩn bị:
• Dụng cụ: Ống nghiệm, đèn cồn, kẹp ống nghiệm.
• Hoá chất: Đường ăn.
Tiến hành:
• Cho khoảng một thìa cafe đường ăn vào ống nghiệm, sau đó đun trên ngọn lửa đèn cồn (hình 2.5).
• Mô tả trạng thái (thể, màu sắc, …) của đường trước và sau khi đun.
• Nêu dấu hiệu chứng tỏ có phản ứng hoá học xảy ra.
Phương pháp giải:
Quan sát thí nghiệm hình 2.5 đồng thời thực hiện theo hướng dẫn để trả lời câu hỏi.
Lời giải chi tiết:
- Trước khi đun: Đường là chất rắn, màu trắng, vị ngọt, không mùi, tan trong nước.
- Sau khi đun: Thu được chất rắn, màu đen, vị đắng, mùi khét, không tan trong nước.
- Dấu hiệu chứng tỏ có phản ứng hoá học xảy ra: có sự thay đổi màu sắc (từ trắng sang đen); vị (từ ngọt sang đắng); mùi (từ không mùi sang khét); độ tan (từ tan trong nước sang chất mới không tan trong nước).
CH tr 19 VD1
Nước đường để trong không khí một thời gian có vị chua. Trong trường hợp này, dấu hiệu nào chứng tỏ có phản ứng hoá học xảy ra?
Phương pháp giải:
Dựa vào sự tính chất sự biến đổi hóa học để trả lời câu hỏi
Lời giải chi tiết:
Dấu hiệu chứng tỏ có phản ứng hoá học xảy ra là sự thay đổi vị của nước đường (từ vị ngọt sang vị chua).
CH tr 19 LT2
Những dấu hiệu nào thường dùng để nhận biết có phản ứng hoá học xảy ra?
Phương pháp giải:
Dựa vào những biến đổi hóa học để trả lời câu hỏi
Lời giải chi tiết:
+ Để nhận biết có phản ứng hoá học xảy ra có thể dựa vào các dấu hiệu sau: có sự thay đổi màu sắc, mùi, … của các chất; tạo ra chất khí hoặc chất không tan (kết tủa); …
+ Ngoài ra, sự toả nhiệt và phát sáng cũng có thể là dấu hiệu của phản ứng hoá học xảy ra.
CH tr 19 TN2

Phương pháp giải:
Quan sát thí nghiệm và trả lời câu hỏi
Lời giải chi tiết:
Mẩu than cháy sáng trong bình khí oxygen. Chạm tay vào thành bình thấy nóng.
CH tr 19 CH5
Trong các phản ứng hóa học ở thí nghiệm 2 và thí nghiệm 3 phản ứng nào tỏa nhiệt, phản ứng nào thu nhiệt?
Phương pháp giải:
Quan sát hai thí nghiệm 2 và 3 để trả lời câu hỏi.
Lời giải chi tiết:
Phản ứng tỏa nhiệt là thí nghiệm 2, phản ứng thu nhiệt là thí nghiệm 3
CH tr 20 LT3
Trong hai phản ứng dưới đây, phản ứng nào là phản ứng toả nhiệt, phản ứng nào là phản ứng thu nhiệt?
a) Phân huỷ đường tạo thành than và nước.
b) Cồn cháy trong không khí.
Phương pháp giải:
Dựa vào tính chất của phản ứng thu nhiệt và phản ứng tỏa nhiệt để trả lời câu hỏi.
Lời giải chi tiết:
a) Phân huỷ đường tạo thành than và nước là phản ứng thu nhiệt.
b) Đốt cháy cồn trong không khí là phản ứng toả nhiệt.
CH tr 20 VD2
Tìm hiểu và chỉ ra thêm một số phản ứng xảy ra trong tự nhiên có kèm theo sự toả nhiệt hoặc thu nhiệt.
Phương pháp giải:
Dựa vào những hiểu biết của em và quan sát ngoài đời sống để trả lời câu hỏi
Lời giải chi tiết:
- Một số phản ứng xảy ra trong tự nhiên là phản ứng thu nhiệt:
+ Phản ứng quang hợp (là phản ứng thu năng lượng dưới dạng ánh sáng).
+ Phản ứng nung vôi.
- Một số phản ứng xảy ra trong tự nhiên là phản ứng toả nhiệt:
+ Phản ứng tạo gỉ sắt.
+ Phản ứng oxi hoá glucose trong cơ thể.